臨床成績
国内第Ⅱ相試験(CPG2-PⅡ試験)(単群、非盲検、多施設共同試験、2012-2016年) 承認時評価資料:国内第Ⅱ相試験(CPG2-PⅡ試験)
- 【目 的】
- 日本人の小児・成人でのMTX排泄遅延時の高MTX血症に対するメグルダーゼ®のMTX低減効果を評価する。
- 【対 象】
-
MTX・LV救援療法の施行によりMTX排泄遅延が認められた成人及び小児患者15例
・ 最大の解析対象集団(Full Analysis Set:FAS):主解析対象集団13例*1、副次解析対象集団14例*1
・ 薬物動態解析対象集団:15例
・ 安全性解析対象集団:15例
*1副次解析対象集団では2回の登録が行われた同一患者の2回目の1例が除外され、主解析対象集団では更にメグルダーゼ®投与前のベースラインでの血漿中MTX濃度が1μmol/L未満の1例が除外された
- 【方 法】
-
MTX*2投与終了から15時間以上経過後かつLV最終投与から2時間以上経過後に、メグルダーゼ®50U/kgを5分間かけて静脈内投与した。メグルダーゼ®投与2時間後からLVの投与*3を開始し、メグルダーゼ®初回投与後48時間の血中MTX濃度が1μmol/L以上の場合、初回投与50~52時間後を目安に、メグルダーゼ®を初回投与時と同じ用法及び用量で追加投与した*4。
*21g/m2以上 *3LVの用法及び用量は、メグルダーゼ®投与48時間まではメグルダーゼ®投与前の血中MTX濃度に基づき決定した用法及び用量を継続することとされ、メグルダーゼ®投与48時間以降は、メグルダーゼ®投与後の各測定時点における血中MTX濃度に基づき決定することとされた *4大量補液、尿のアルカリ化、利尿剤の投与等の支持療法を実施することとされた
 *5体重の小数点1桁を四捨五入して50を乗じた値を投与量とし、1バイアル1,000Uを1mLの生理食塩水で溶解した後に投与量調整を行った
*5体重の小数点1桁を四捨五入して50を乗じた値を投与量とし、1バイアル1,000Uを1mLの生理食塩水で溶解した後に投与量調整を行った
選択基準
なお、MTX・LV救援療法の標準的な管理手順として、MTX投与開始24、42、48及び72時間後の血中MTX濃度を基にLVの投与量が決定されることを踏まえ、CPG2-PⅡ試験では、採血時点が2時間早く設定された。
なお、急性腎障害の徴候は、次の①又は②のいずれかを満たす場合と定義された。 ① MTX投与開始12時間以降に血清クレアチニン値が下表における基準値上限以上、又はクレアチニンクリアランス若しくはGFR(糸球体濾過量)が70mL/min未満である。 ② MTX投与前と比較して血清クレアチニン値が2倍以上増加、若しくは直近2回の採血で連続して1.5倍以上増加、かつ増加している。
| 年齢 | 血清クレアチニン 上限値 |
|
|---|---|---|
| 男性 | 女性 | |
| 1歳以上 2歳未満 |
0.6 | 0.6 |
| 2歳以上 6歳未満 |
0.8 | 0.8 |
| 6歳以上 10歳未満 |
0.9 | 0.9 |
| 10歳以上 13歳未満 |
1.1 | 1 |
| 13歳以上 16歳未満 |
1.5 | 1.2 |
| 16歳以上 | 1.7 | 1.2 |
除外基準
- 【評価項目】
-
- 主要評価項目:
- CIR(Clinically important reduction)*7達成割合
- 副次評価項目:
- MTX関連有害事象*8の非発現割合、MTX関連有害事象(頻度、重症度など)、MTX・4-deoxy-4-amino-N10-methylpteroic acid(DAMPA)の血漿中濃度、有害事象の発現割合、副作用 など
- 【解析計画】
- 有効性の解析はFASを対象に実施し、有害事象及び副作用の発現割合の解析は安全性解析対象集団を対象に実施した。主要評価項目については、ベースラインであるメグルダーゼ®投与前の直近の血漿中MTX濃度が1μmol/L以上の患者を対象として、メグルダーゼ®投与後のCIR達成割合を求めた。区間推定は、二項分布に基づく正確な方法を用いて、両側95%CIを算出した。なお、サブグループ解析である成人患者及び小児患者でのCIR達成割合は事前に規定されていた。
患者背景、安全性解析対象集団
安全性解析対象集団のベースライン時における患者背景は以下の通りであった。
| 項目 | 安全性解析対象集団(n=15)* | |
|---|---|---|
| 性別 | 男性 | 9 (60.0%) |
| 女性 | 6 (40.0%) | |
| 原疾患 | 骨肉腫 | 9 (60.0%) |
| 急性リンパ性白血病 | 3 (20.0%) | |
| 非ホジキンリンパ腫 | 1 (6.7%) | |
| びまん性大細胞型 B細胞性リンパ腫 |
1 (6.7%) | |
| 小脳髄芽腫 | 1 (6.7%) | |
| 薬物アレルギー | なし | 15 (100.0%) |
| 年齢中央値、歳[範囲] | 16.0 [1-75] | |
| 身長中央値、cm[範囲] | 156.0 [78.5-177.5] | |
| 体重中央値、kg[範囲] | 47.0 [10.7-78.1] | |
| MTX排泄遅延診断時の 血漿中MTX濃度中央値、μmol/L[範囲] |
51.0 [1.02-692.3] | |
| メグルダーゼ®投与前の最終LV投与量中央値、mg/m2[範囲] | 15.5 [0.0-30.0] | |
*副次解析対象集団では2回の登録が行われた同一患者の2回目の1例が除外され、主解析対象集団では更にメグルダーゼ®投与前のベースラインでの血漿中MTX濃度が1μmol/L未満の1例が除外された
有効性
CIR(Clinically important reduction)*1達成割合【主要評価項目、FAS:主解析対象集団】、成人患者及び小児患者でのCIR達成割合【サブグループ解析、FAS:主解析対象集団】
CIR達成割合(両側95%CI)は76.9(46.2-95.0)%であった。
また、成人患者及び小児患者それぞれにおけるCIR達成割合は以下の通りであった。
| 対象患者数 (n) |
メグルダーゼ®投与後のMTX濃度の最大値 | CIR達成割合(%) (両側95%CI) |
閾値*2 (%, moving target design) |
|
|---|---|---|---|---|
| 1μmol/L未満 である患者数 |
1μmol/L以上 である患者数 |
|||
| 13*3 | 10 | 3 | 76.9 (46.29-95.0) |
42.7 |
| 成人患者(サブグループ解析) | ||||
| 5 | 5 | 0 | - | - |
| 小児患者(サブグループ解析) | ||||
| 8 | 5 | 3 | - | - |
*1CIR:メグルダーゼ®投与開始20分後から4日後までのすべての採血時点で中央測定による血漿中MTX濃度が1μmol/L未満
*2メグルダーゼ®投与前の血漿中MTX濃度(中央測定)が100μmol/Lより高値の患者の閾値を15%、100μmol/L以下の患者の閾値を45%とし、実際にメグルダーゼ®を投与された患者におけるメグルダーゼ®投与前の血漿中MTX濃度(中央測定)を基に算出した併合閾値
*3登録例15例から、2回の登録が行われた同一患者の2回目の1例及びメグルダーゼ®投与前のベースラインでの血漿中MTX濃度が1μmol/L未満の1例がそれぞれ除外された13例
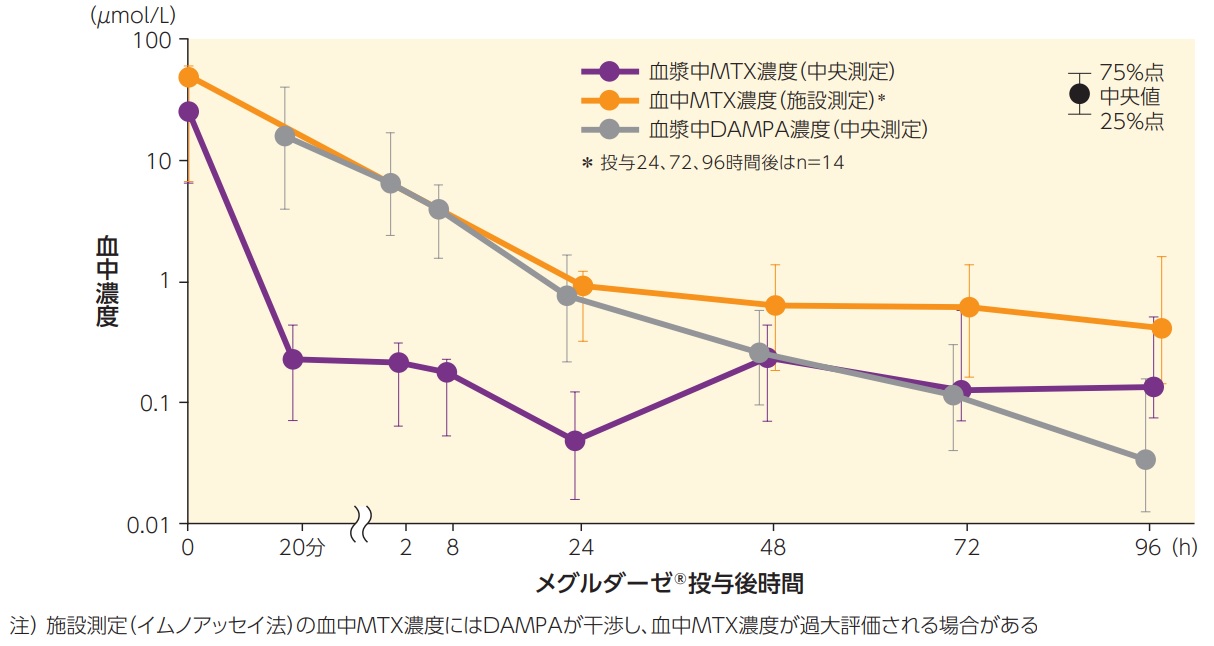
MTXとその代謝物(DAMPA)の薬物動態
血漿中MTX濃度(中央測定)、血中MTX濃度(施設測定)注)及び血漿中DAMPA濃度(中央測定)
【副次評価項目、薬物動態解析対象集団】
薬物動態解析対象集団15例において、メグルダーゼ®投与20分後の中央測定の血漿中MTX濃度中央値は1μmol/Lを下回った。メグルダーゼ®投与24時間後の中央測定の血漿中MTX濃度中央値は0.0485μmol/L、施設測定の血中MTX濃度中央値は0.940μmol/Lであった。
 血漿中MTX濃度(中央測定)
血漿中MTX濃度(中央測定) 血漿中MTX濃度(施設測定)*
血漿中MTX濃度(施設測定)* 血漿中DAMPA濃度(中央測定)
血漿中DAMPA濃度(中央測定)- *投与24、72、96時間後はn=14
 75%点
75%点中央値
25%点
注)施設測定(イムノアッセイ法)の血中MTX濃度にはDAMPAが干渉し、血中MTX濃度が過大評価される場合がある
メグルダーゼ®静注用1000添付文書(第1版):12. 臨床検査結果に及ぼす影響(一部抜粋)
12.1 イムノアッセイ法による血中メトトレキサート濃度測定への干渉
抗体産生
免疫原性評価(抗グルカルピダーゼ抗体)【安全性解析対象集団】 メグルダーゼ®投与前、投与1、3、及び6ヵ月後のグルカルピダーゼに対する抗体産生率は以下の通りであった。
<グルカルピダーゼに対する抗体産生の有無>
| 時点 | 抗体産生 | 抗体産生率、%(95%CI) | |
|---|---|---|---|
| なし | あり | ||
| 投与前 | 13 | 2 | 13.3 (1.7-40.5) |
| 1ヵ月 | 10 | 5 | 33.3 (11.8-61.6) |
| 3ヵ月 | 13 | 2 | 13.3 (1.7-40.5) |
| 6ヵ月 | 11 | 2 | 15.4 (1.9-45.4) |
安全性
MTX関連有害事象の非発現割合【副次評価項目、FAS:副次解析対象集団】 MTX関連有害事象(腎機能障害の進行、重症粘膜炎、発熱性好中球減少症、発熱、感染および寄生虫症)の非発現割合は14例中5例(35.7%)であった。
MTX関連有害事象(頻度、重症度)【副次評価項目、FAS:副次解析対象集団】 MTX関連有害事象の発現割合は14例中9例(64.3%)であった。また、事象別MTX関連有害事象の発現状況は、以下の通りであった。
| 事象 | 有害事象 発現患者数 |
MTXと関連 | MTXと関連のある有害事象の発現例数 | |||||
|---|---|---|---|---|---|---|---|---|
| なし | あり | Grade1 | Grade2 | Grade3 | Grade4 | Grade5 | ||
| 腎機能障害の進行* | 8 | - | 8 | - | - | - | - | - |
| 重症粘膜炎 | 2 | 0 | 2 | 0 | 0 | 2 | 0 | 0 |
| 発熱性好中球減少症 | 4 | 0 | 4 | 0 | 0 | 3 | 1 | 0 |
| 発熱 | 6 | 0 | 6 | 3 | 3 | 0 | 0 | 0 |
| 感染および寄生虫症 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 |
■有害事象
有害事象は安全性解析対象集団15例中15例に計181件の有害事象が認められた。重篤な有害事象は5例(33.3%、11件、内訳:血小板数減少3例、低カリウム血症2例、貧血2例、高血圧1例、白血球数減少1例、敗血症1例、好中球数減少1例[重複例あり])で、いずれもメグルダーゼ®との因果関係はないと判断された。
投与中止及び死亡に至った有害事象は認められなかった。
主な有害事象(全Gradeで10%以上に発現した有害事象)
| 事象名 | 安全性解析対象集団(n=15) | |
|---|---|---|
| 全Grade | Grade3以上 | |
| 有害事象発現例数 | 15 (100.0%) | 13 (86.7%) |
| 貧血 | 11 (73.3%) | 9 (60.0%) |
| 血小板数減少 | 9 (60.0%) | 6 (40.0%) |
| 低アルブミン血症 | 9 (60.0%) | 0 (0.0%) |
| 好中球数減少 | 8 (53.3%) | 6 (40.0%) |
| 白血球数減少 | 8 (53.3%) | 5 (33.3%) |
| 低ナトリウム血症 | 7 (46.7%) | 1 (6.7%) |
| 低カリウム血症 | 6 (40.0%) | 4 (26.7%) |
| 高血圧 | 6 (40.0%) | 3 (20.0%) |
| 嘔吐 | 5 (33.3%) | 1 (6.7%) |
| 口内炎 | 5 (33.3%) | 1 (6.7%) |
| 血中クレアチニン増加 | 5 (33.3%) | 1 (6.7%) |
| 低カルシウム血症 | 5 (33.3%) | 2 (13.3%) |
| 体重減少 | 5 (33.3%) | 0 (0.0%) |
| 発熱性好中球減少症 | 4 (26.7%) | 4 (26.7%) |
| 事象名 | 安全性解析対象集団(n=15) | |
|---|---|---|
| 全Grade | Grade3以上 | |
| 下痢 | 4 (26.7%) | 1 (6.7%) |
| 発熱 | 4 (26.7%) | 0 (0.0%) |
| 低リン酸血症 | 4 (26.7%) | 0 (0.0%) |
| 悪心 | 3 (20.0%) | 1 (6.7%) |
| 便秘 | 3 (20.0%) | 0 (0.0%) |
| 血中ビリルビン増加 | 3 (20.0%) | 0 (0.0%) |
| 腹痛 | 2 (13.3%) | 0 (0.0%) |
| 限局性浮腫 | 2 (13.3%) | 0 (0.0%) |
| 尿中β2ミクログロブリン増加 | 2 (13.3%) | 0 (0.0%) |
| 食欲減退 | 2 (13.3%) | 0 (0.0%) |
| 高カリウム血症 | 2 (13.3%) | 0 (0.0%) |
| 頭痛 | 2 (13.3%) | 0 (0.0%) |
| 咳嗽 | 2 (13.3%) | 0 (0.0%) |
| 鼻出血 | 2 (13.3%) | 0 (0.0%) |
| しゃっくり | 2 (13.3%) | 0 (0.0%) |
副作用 副作用は、メグルダーゼ®が投与された15例中2例(13.3%)に認められ、過敏症及び血中ビリルビン増加が各1例(6.7%)であった。
 医療関係者向けサイト
医療関係者向けサイト

